[2024-05-17] (Accès libre) La Commission européenne a publié le 17 mai 2024 les résultats de sa 8ème enquête auprès des organismes notifiés (ON) pour les dispositifs médicaux (DM) et les dispositifs médicaux de diagnostic in vitro (DMDIV). Cette enquête, intitulée « 8th notified bodies survey on certifications and applications (MDR/IVDR) », fait le point de la situation au 29 février 2024 sous forme de 43 diapositives. Elle regroupe les résultats des réponses des 45 organismes notifiés sollicités (100 % de réponses).
Nous avions publié un article en avril 2024 à l’occasion d’une version précédente de cette enquête. Les indicateurs associés aux 8 éditions de l’enquête sont regroupés dans un tableau de bord, qu’il faut consulter en cliquant sur les onglets en haut.
On peut se réjouir de voir que le nombre de certificats émis selon le règlement (UE) 2017/745 (RDM) et (UE) 2017/746 (RDMDIV) continue de s’accroître, et que la rapidité d’émission de ces certificats augmente grâce au nombre plus élevé d’organismes notifiés.
Si l’on veut analyser plus en détail les données présentées dans la dernière enquête, on constate globalement que, pour 84 % des demandes déposées auprès des organismes notifiés, un accord écrit est signé en moins de 4 mois : c’est essentiel pour les dispositifs hérités (« legacy devices »). En effet, pour que ces dispositifs puissent continuer à être mis sur le marché après le 26 mai 2024, il faut non seulement qu’une demande ait été déposée auprès d’un ON avant cette même date, mais aussi qu’un accord écrit soit signé avec un ON avant le 26 septembre 2024 (donc, 4 mois plus tard). En conséquence, les fabricants concernés ont de bonnes chances d’y parvenir.
En revanche, si l’on suppose que l’augmentation du nombre de certificats émis selon le RDM restera stable autour de + 40 % tous les 4 mois, cela conduirait à 13 667 certificats émis à fin septembre, à comparer à 25 034 certificats qui existaient précédemment selon les directives 93/42/CEE (DDM) et 90/385/CE (DDMIA), soit un déficit global de plus de 40 % des certificats existants antérieurement.
En creusant un peu la question, si l’on se focalise sur la DDM et sur les types de certificats les plus utilisés, on peut établir ce tableau :
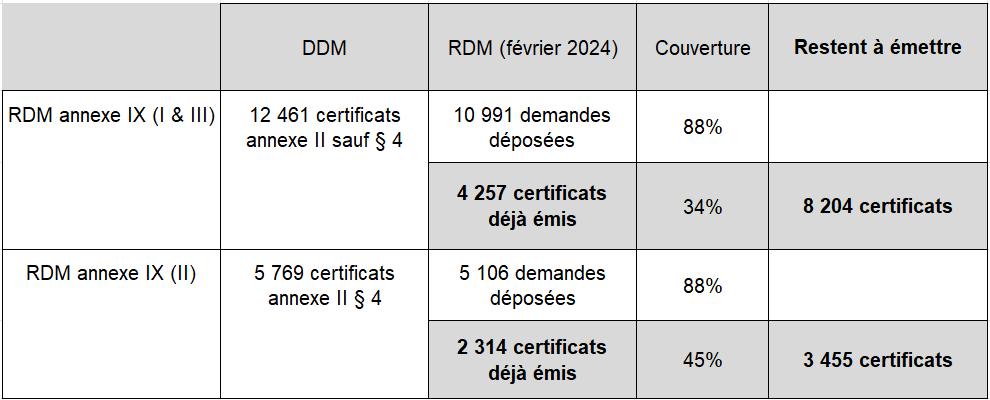
Analyse des principaux certificats DDM restant à transformer en certificats RDM
Présenté sous cette forme, ce résumé est beaucoup plus inquiétant, sans parler des résultats présentés pour le RDMDIV que nous n’avons pas analysés ici. Les certificats qui restent à émettre correspondent-ils en majorité à des dispositifs hérités ? Si oui, les fabricants pourront-ils se conformer à temps aux exigences pour pouvoir bénéficier des conditions requises à la poursuite de la mise sur le marché de leurs produits, et obtenir un certificat selon le RDM avant l’expiration des certificats selon la directive correspondante ?
Nous y verrons plus clair fin septembre 2024. En attendant, croisons les doigts pour que la transition se fasse sans heurts pour les patients !
Article rédigé par Denys Durand-Viel, Président de DM Experts SAS
